张家庆1,高彬文1,王献伟2,马 强1,高 原3,任巧玲1,白献晓1,邢宝松1*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450008; 2. 河南省畜牧总站 河南 郑州 450008;3. 新县畜牧局,河南 新县 465550)
摘要:研究猪卵泡期内有腔卵泡发育和闭锁中颗粒细胞自噬与凋亡、卵泡内调控因子、类固醇激素及相关酶类的变化,为提高排卵前卵泡发育数量提供理论依据,从猪卵泡期卵巢中分离3~5 mm有腔卵泡,根据发育变化分为健康卵泡、早期和晚期闭锁3类,应用HE染色观察内部形态结构变化,应用酶免法检测卵泡液中雌二醇(E2)和孕酮(P4)的浓度变化,采用Real–time PCR方法检测自噬相关基因(Becline[a1] 、LC3B、 ATG3、 ATG5 、ATG7)、凋亡相关基因(Caspase-3、Bim 、Bcl-2 和Bax)、类固醇合成酶基因( CYP11A1、3βHSD、CYP17A1、CYP19A3)、激素受体和卵泡内关键调控基因(FSHR、ERα、CART、SMAD4)在不同时期卵泡中的表达变化。结果表明,早期和晚期闭锁卵泡中P4/ E2 的比值显著高于健康卵泡,自噬和凋亡相关基因的表达水平在早期和晚期闭锁的卵泡中显著高于健康卵泡,类固醇合成酶基因CYP11A1和3βHSD的表达量在早期和晚期闭锁卵泡中显著高于健康卵泡,CYP17A1和CYP19A3的表达量在早期和晚期闭锁卵泡中显著低于健康卵泡,FSHR、ERα和SMAD4的表达量在早期和晚期闭锁卵泡中显著低于健康卵泡,而CART的表达量则呈现相反的趋势。综上,[a2] 颗粒细胞自噬和凋亡是卵泡闭锁的主要诱因,而类固醇合成酶基因(CYP11A1和3βHSD)通过提高卵泡液中孕酮的水平加速了卵泡闭锁的进程。。
关键词:猪;有腔卵泡;卵泡发育;卵泡闭锁
Analysis of the related gene expression and the changes of hormone levels in medium follicular development and atresia during pig follicular phase
ZHANG Jiaqing1, GAO Binwen1, WANG Xianwei2, MA Qiang1, GAO yuan3, REN Qiaoling1, BAI Xianxiao1, XING Baosong1
(1. Institute of Animal Husbandry and Veterinary Science, Henan Academy of Agricultural Sciences,Zhengzhou 450008,China; 2. Henan Provincial Animal Husbandry General Station, Zhengzhou 450008, China; 3. Xinxian Animal Husbandry Bureau, Xinxian 465550,China)
Abstract: [a3] This study was to analyse the changes of autophagy and apoptosis, intraovarian regulatory factors, steroid hormones and steroidogenic enzymes in antral follicle development and atresia during porcine follicular phase, so as to provide theoretical basisfor increasing the preovulatory follicle numbers. Antral follicles about 3~5 mm in diameter were isolated from porcine ovaries in follicular phase and classified as three groups: healthy follicles, early atretic follicles and progressed atretic follicles. HE staining was used to observe the follicular morphological structure, and enzyme-linked immunoabsorbent assay (ELISA) method was applied to examine the changes of estradiol (E2) and progesterone (P4) concentrations in follicular fluid. The relative expression levels of autophagy related genes (Becline、LC3B、 ATG3、 ATG5 and ATG7), apoptosis related genes (Caspase-3、Bim、Bcl-2 and Bax), steroidogenic enzyme genes (CYP11A1、3βHSD、CYP17A1 and CYP19A3), hormone receptor and intraovarian regulatory genes ( FSHR、ERα、CART and SMAD4) in different types of follicles were detected by Real-time PCR method.The ratio of P4 to E2 was significantly decreased in healthy follicles as compared to early atretic follicles and progressed atretic follicles(P < 0.05). The relative expression levels of autophagy and apoptosis related genes were increased in early atretic follicles and progressed atretic follicles compared to healthy follicles(P < 0.05). The mRNA levels of CYP11A1and3βHSD were enhanced in early atretic follicles and progressed atretic follicles compared with healthy follicles(P < 0.05). The relative expression levels of FSHR and ERα in early atretic follicles and progressed atretic follicles were significantly lower than that of healthy follicles(P < 0.05). The mRNA levels of SMAD4 in healthy follicles was significantly higher than that of early atretic follicles and progressed atretic follicles, and the relative expression levels of CART showed the reverse change trend(P < 0.05). Apoptosis and autophagy are the main cause of follicular at resia, whereas steroidogenesis enzyme genes (CYP11A1 and 3β-HSD) accelerate atretic progression by increasing progesterone levels
Key words: swine ;antral follicles;follicular development;follicular atresia.
能繁母猪是猪场生产的基础,其繁殖力的高低对于猪场效益具有至关重要的作用。母猪的排卵数常被视为潜在的产仔数,而排卵数量多少取决于卵泡的初始征集数量和终末闭锁数量。研究表明,小母猪在初生后10 d左右两侧卵巢上约有500万个原始卵泡;而在其能繁时期,至多1 600个卵泡能发育至成熟排卵,其余卵泡均在发育过程中闭锁退化消失[1]。在猪卵泡期开始,约有50个卵泡被征集启动生长,而最后发育至成熟并排卵的数量只有12~20个[2-3]。卵泡闭锁能够发生在卵泡生长和发育的不同时段,但绝大多数卵泡在发育至直径6 mm之前闭锁退化消失[4-5]。卵泡的生长和发育是一个复杂的生物学过程,受到多种因素共同调控,包括类固醇激素、各种代谢酶类、局部生长因子等。前人研究表明,类固醇激素如雌激素(E2)和孕激素(P4)等,在卵泡发育和闭锁过程中具有重要的调控作用[6]。E2能促进卵泡内颗粒细胞增殖,抑制卵泡内颗粒细胞凋亡和促进卵泡成熟排卵。P4 能够促进卵泡内颗粒细胞凋亡和加快卵泡闭锁退化。细胞自噬又称Ⅱ型程序性细胞死亡,最近研究表明,凋亡和自噬共同存在于卵泡发育和闭锁过程中,且两者之间存在交互调控作用[7]。目前,在猪卵泡期有腔卵泡(3~5 mm)发育过程中,卵泡内类固醇激素及合成酶类之间的变化与卵泡内颗粒细胞自噬与凋亡及内部调控因子之间的密切关系迄今鲜见报道。基于此,本研究对不同类型的中等有腔卵泡(健康卵泡、早期闭锁、晚期闭锁)类固醇激素及合成酶变化与颗粒细胞自噬和凋亡及关键调控因子之间的关系进行了分析,以期为提高动物繁殖效率提供理论基础。
1 材料和方法
1.1 试验材料
本试验中所用卵巢来自10头体质量为120~140 kg的商品母猪,样品采自新乡市辉县屠宰场。母猪屠宰后立刻取下整个子宫,然后根据卵巢发育变化(卵泡直径大小、黄体发育变化等)选择处于卵泡期内的发育良好的卵巢,放入已加入双抗(含青霉素、链霉素各 500 IU/mL)的37 ℃生理盐水中,保温瓶内1~3 h内带回实验室进行后续操作。
1.2 试验方法
1.2.2 颗粒细胞与卵泡液的收集 为了获得单个卵泡内的颗粒细胞和卵泡液,卵泡分离经初步鉴定后,分别将单个卵泡置于细胞专用分离管中(分离管中上部具有网筛,可滤过颗粒细胞和卵泡液,同时将卵泡内外膜等组织滞留在网筛之上),使用眼科镊轻轻将卵泡壁撕破,然后低速离心(2 000~3 000 r/min)2 min即可,然后将卵泡壁组织去除进行高速离心分离颗粒细胞核卵泡液,分离完后分别将颗粒细胞和卵泡液置于-80 ℃冰箱中保存。
表1 实时荧光定量PCR所用引物
|
引物名称 |
登录号 |
正向引物 |
反向引物 |
|
3β-HSD |
AF232699.2 |
ACGACACACCTCCCCAAAG |
CCTCACACCCACATCCACG |
|
CYP17A1 |
NM_214428 |
CAAGACGAACGCAGAAAG |
AGAGGCAGAAGTCTCCACA |
|
FSHR |
NM_214386 |
AGTCCCTCGGTTCCTTAT |
CATCTTTCCAGGGTGAT |
|
ERα |
NM_214220.1 |
ATGAAGTGCAAGAACGTGGTG |
AATGCGATGGAGTTGAGCC |
|
CYP11A1 |
X13768.1 |
GGCTCCAGAGGCCATAAAGA |
ACTCAAAGGCGAAGCGAAAC |
|
CYP19A3 |
NM_214431 |
GCTGCTCATTGGCTTAC |
TCCACCTATCCAGACCC |
|
Becline |
NM_001044530 |
AGGAGCTGCCGTTGTACTGT |
CACTGCCTCCTGTGTCTTCA |
|
LC3B |
NM_001190290 |
CCGAACCTTCGAACAGAGAG |
AGGCTTGGTTAGCATTGAGC |
|
ATG3 |
AK236659 |
CACGACTATGGTTGTTTGGCTATG |
GGTGGAAGGTGAGGGTGATTT |
|
ATG5 |
NM_001037152 |
GGCATTATCCGATTGGTTTG |
GTCATTCTGCAGTCCCATCC |
|
ATG7 |
AK240528 |
AGATTGCCTGGTGGGTGGT |
GGGTGATGCTGGAGGAGTTG |
|
Bim |
NM_001127330 |
CAGACAGAGCGGCAAGGTA |
AGGATCGAGACAGCAGGGA |
|
Caspase3 |
NM_214131 |
AATGGCATGTCGATCTGG |
TCCCACTGTCCGTCTCAA |
|
BCL-2 |
XM_003121700 |
TTCTTTGAGTTCGGTGGGG |
CCAGGAGAAATCAAATAGAGGC |
|
BAX |
XM_003127290 |
AGCTGAGCGAGTGTCTCAA |
CAGTTGAAGTTGCCGTCAG |
|
SMAD4 |
NM_214072 |
TTTGCGTCAGTGTCATCG |
TGCTCTGCCTTGGGTAAT |
|
CART |
NM_001099925 |
CCGCCCTGCTGCTGCTGCTAC |
AGGGACTTGGCCATACTTCTTCTC |
|
GAPDH |
NM_001206359 |
GGACTCATGACCACGGTCCAT |
TCAGATCCACAACCGACACGT |
1.3 数据分析
采用GAPDH为内参照,以2-△△Ct方法计算各目的基因的相对表达量,具体计算方法参照已发表文献[11],采用SPSS 17.0软件one-way ANOVA方法对不同类型卵泡内各基因的mRNA水平及卵泡内激素浓度的变化进行差异显著性检验,以平均值±标准差表示,P < 0.05 定为显著性差异。
2 结果与分析
2.1 不同类型猪有腔卵泡中E2和P4浓度的变化
健康卵泡液中E2的水平显著高于早期闭锁和晚期闭锁卵泡;P4的浓度则呈现出相反的趋势,即健康卵泡液中的水平显著低于早期和晚期闭锁卵泡。 当卵泡出现早期闭锁时,卵泡液中E2的水平开始下降,而P4的水平开始增加,P4 /E2的比值随着有腔卵泡闭锁程度的增加而升高 (图1)。
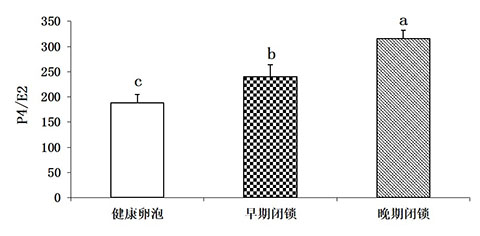
不同字母表示不同在0.05 水平上差异显著(下同)
2.2 类固醇激素合成酶和激素受体在有腔卵泡中的表达变化
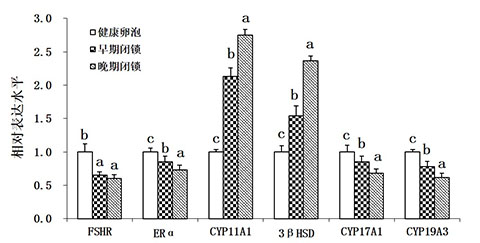
从图2可以看出,与健康卵泡相比较,随着卵泡闭锁程度的加深,FSHR和ERα的表达水平在早期闭锁和晚期闭锁卵泡中显著降低;CYP11A1和3βHSD的表达水平在健康卵泡中较低,但随着卵泡闭锁程度的加深,两者的表达水平在早期和晚期闭锁卵泡中均显著升高;CYP17A1和CYP19A3的水平在健康卵泡中表达较高,但随着卵泡闭锁程度的加深,两者的表达水平在早期和晚期闭锁卵泡中均显著下降。
2.3 不同类型猪有腔卵泡中自噬和凋亡相关基因表达变化
由图3可知,自噬相关基因(Becline、LC3B、ATG3、ATG5和ATG7)mRNA的表达水平在健康卵泡中相对较低,但随着卵泡闭锁程度的加深,自噬相关基因的表达水平均显著升高,其中自噬标志性分子LC3B的表达水平在早期和晚期闭锁卵泡中的表达水平显著高于其他自噬标志分子。从图4中可以看出,凋亡相关基因(Caspase-3、Bim)mRNA的表达水平在健康卵泡中相对较低,而在早期和晚期闭锁卵泡中显著升高;而Bcl-2与Bax相对表达量的比值则呈现出相反的趋势。
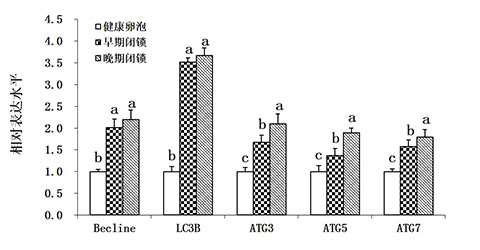
图3 不同类型卵泡中自噬相关基因表达水平
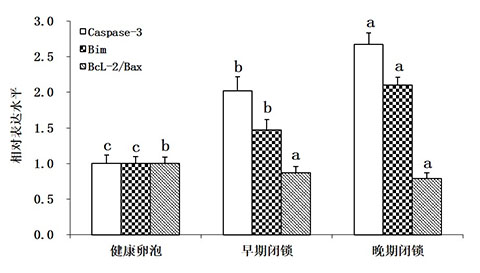
图4 不同类型卵泡中凋亡相关基因表达水平
2.4 不同类型猪有腔卵泡中SMAD4和CART表达变化
如图5所示,SMAD4 mRNA的水平在健康卵泡中表达显著升高,而在早期和晚期闭锁的卵泡中期表达量显著下降;CART mRNA的水平在健康卵泡中表达显著降低,而在早期和晚期闭锁的卵泡中其表达水平显著升高。
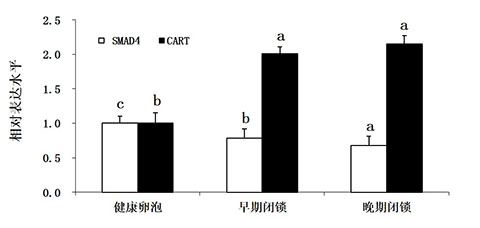
图4 不同类型卵泡中SMAD4和CART基因表达水平
3讨论
卵泡液中E2和P4的水平变化能够表明卵泡内颗粒细胞的生理状态,并且P4与E2的比值与细胞内核酶的活性呈现正相关[12-13]。众多研究表明,利用两者之间的比值能够更加客观地评价卵泡闭锁的程度[14-15]本研究结果表明,两者之间的比值与自噬和凋亡相关基因的表达水平呈显著正相关,这说明利用两者的比值可作为评判中等有腔卵泡的闭锁程度。胆固醇是体内各种类固醇激素的合成的重要原料,它在体内经胆固醇侧裂酶代谢后可转化为孕烯醇酮, 而由胆固醇合成的孕烯醇酮是合成其类固醇激素如雌激素、孕激素等的前体物质。研究表明, 类固醇激素在有腔卵泡的生长和闭锁过程中起着核心调控作用[6]。在本研究中CYP11A1和3βHSD在健康卵泡中的表达量相对较低,与此同时两者在早期和晚期闭锁卵泡中呈现显著升高趋势,这与Sanne等[16]研究报道相一致,他们发现CYP11A1和3βHSD是孕酮合成主要关键酶类。CYP17A1和CYP19A3两种酶类在健康卵泡中表达较高,而在早期和晚期闭锁卵泡中呈现下降趋势,这与前人研究报道相吻合,先前研究表明,CYP17A1是合成雄激素的主要酶类,而CYP19A3可利用雄烯二酮或睾酮合成雌激素[17]。此外,FSHR和Erα的表达水平在健康卵泡中较高,而在早期和晚期闭锁卵泡中呈现下降趋势,这也说明了闭锁卵泡中相关激素受体的表达与相关酶类的合成水平相一致,从而一起作用促使卵泡发生闭锁。
SMAD4 是哺乳动物中唯一的一种共介导型Smads, 它在TGF-β超家族信号转导中起非常关键的作用,它的缺失会使该信号通路中断,使细胞外界信号信息无法传递[18]。Guéripel等[19]研究表明,促性腺激素主要促使SMAD4表达进而来增强TGF-β/BMP通路的调控作用。Wang等[20]研究发现,干扰内源性SMAD4可降低FSH介导的颗粒细胞增殖和类固醇激素的生成。CART是一种神经肽物质,研究已证实,在一定浓度范围内它能阻止牛卵泡的正常发育,导致卵泡发育迟缓,是诱发卵泡闭锁的一个重要因子[21]。Jones等[22]研究表明,CART能有效抑制牛卵泡颗粒细胞雌激素的分泌。在本研究中,SMAD4在健康卵泡中的表达量显著高于早期和晚期闭锁卵泡,而CART在健康卵泡中的表达量则显著低于早期和晚期闭锁卵泡,这些差异说明SMAD4对卵泡的发育有促进作用,而CART对猪有腔卵泡的发育有抑制作用,推测很可能是SMAD4促进了颗粒细胞的增殖和雌激素的分泌,而CART起到相反的作用。
细胞的死亡方式包括凋亡、自噬和坏死3种类型,其中Ⅰ型细胞程序性死亡为凋亡,自噬为Ⅱ型程序性死亡。本研究结果发现,自噬和凋亡共同参与调控有腔卵泡的发育和闭锁,并且在卵泡中颗粒细胞是发生凋亡和自噬的主要细胞[23]。当前研究发现,与健康卵泡相比,自噬相关基因(Becline、LC3B、ATG3、ATG5、ATG7)在早期和晚期闭锁卵泡中的表达量均显著上升,与此同时凋亡相关基因(Caspase-3和Bim)的表达量在闭锁卵泡中同样呈现出显著上升的趋势,并且Bcl-2/Bax的比值在闭锁卵泡中呈现出显著下降的趋势,且自噬和凋亡相关基因的表达量与P4/E2比值呈现出负相关,这些结果表明在卵泡闭锁过程中生殖激素和自噬与凋亡相关基因共同参与了调控早期和晚期卵泡的闭锁。
综上所述,卵泡的闭锁是一个极其复杂的生物学过程,受到动物机体内分泌和卵泡内相关因子的多种调控机制干预。本研究通过分析不同类型卵泡中生殖激素的浓度变化、相关激素合成酶的表达水平、自噬与凋亡相关基因的表达量和卵泡内重要调控基因的表达变化,为提高多胎动物排卵前卵泡发育数量和产仔数量提供了理论依据。
参考文献:
[16] Sanne J L, Krueger K E. Expression of cytochrome P450 side-chain cleavage enzyme and 3β-hydroxysteroid dehydrogenase in the rat central nervous system: A study by polymerase chain reaction and in situ hybridization [J]. Journal of neurochemistry, 1995,65(2):528-536.
[18] 王伟. BMP/Smad 信号通路对猪卵泡颗粒细胞的影响[D]. 南京:南京农业大学,2010.
[23] 吴春丽, 郭燕君, 徐海琦,等. 自噬与哺乳动物卵泡闭锁[J].中国细胞生物学学报, 2013(9):1397-1404..
收稿日期:2016-05-20
基金项目:河南省科技攻关项目(162102110036)
作者简介:张家庆(1982 -),男,河北沧州人,助理研究员,博士,主要从事猪遗传育种与繁殖。 E-mail: zjq8650612@163.com
﹡通讯作者:邢宝松(1969-),男,河南新密人, 副研究员,博士,主要从事猪遗传育种。E-mail:baosong@126.com